L’autore dell’articolo
L’articolo che presento è la traduzione dall’inglese del saggio che è stato scritto dal Prof. Michael J. Laing (1937–2012) , professore emerito di Chemica all’ University of Natal, Durban (ora University di KwaZulu-Natal) , South Africa . Si è dedicato molto agli aspetti educativi della chimica e alla storia della tavola periodica di Mendeleev . Ho ritenuto presentare questo suo saggio su l’ evoluzione delle Tavole Periodiche di Dmitrii Mendeleev perché grazie ad esso abbiamo una sintesi efficace del percorso compiuto da Mendeleev . Ci fa partecipe delle difficoltà , degli ostacoli e ripensamenti da compiuti da Mendeleev. Un lavoro di qualità non solo storico ma anche didattico .
Le Differenti Tavole Periodiche di Dmitrii Mendeleev
Esamineremo il cambiamento del formato della tavola periodica , che ci offrirà informazioni sul pensiero e le scoperte di Mendeleev in chimica , dalla sua prima sistemazione del 1869 a quella finale del 1905. E’ istruttivo confrontare queste tavole con quelle pubblicate nei testi scolastici in Russia nel 1931 e 1969 ( il centesimo anniversario della tavola periodica ). Il libro del 1931 è la decima edizione rivista dei Osnovy Khimii dello stesso Mendeleev . Il libro del 1969 Osnovy Obshchei Khimii è di Nekarasov . Le tavole in questi due libri collegano nel tempo la forma usata per il monumento che celebra il centenario della nascita di Mendeleev , eretto nel 1934 a San Pietroburgo, in Russia.
La concezione iniziale della Periodicità
La Figura 1 mostra la tavola periodica come venne pubblicata da Mendeleev nel 1869 . Gli elementi sono in colonne e ordinati in base al peso atomico dall’alto al basso . I gruppi , come noi li conosciamo vanno da sinistra a destra , per esempio : N , P , As , Sb , Bi. Ci sono dei punti interrogativi per gli elementi mancanti di peso atomico 45 , 68 , e 70 che egli è sicuro che devono esistere ma che non sono stati ancora scoperti. Il Tallio , Tl , e il Piombo , Pb , sono posizionati “ sotto “ Cs e Ba rispettivamente, a causa dei loro fuorvianti stati di ossidazione di 1+e 2+ . Anche Hg e Au sono posizionati in modo errato. Da notare il collocamento di quegli elementi che sono posizionati in accordo al loro peso atomico come era accettato al momento : In 75 ; Ce 92 ; Ur 116 .

Era chiaro a Mendeleev che questi pesi erano sbagliati ( l’uranio tra stagno e cadmio ! ) , così durante il 1870 egli ottenne campioni puri di questi tre elementi e determinò il loro calore specifico . Usò poi la legge di Dulong e Petit per determinare il loro corretto peso atomico : In 113 , Ce 138 , U 240. Questi valori vennero incorporati nella sua straordinaria tabella del 1871 , riprodotta nella Figura 2 .

La ” forma breve ” della Tavola Periodica
Questa tabella riveduta è abbastanza ben completa , e il formato è riconoscibile come quello che è diventato la “forma breve” che fu largamente usata fino agli anni ‘50 del secolo scorso . Gli elementi sono disposti orizzontalmente secondo il peso atomico con i gruppi sistemati in colonne verticali . Ciascun gruppo verticale contiene due famiglie legate da un comune stato di ossidazione: per esempio , nel gruppo II ci sono Be , Ca , Sr , Ba e Mg , Zn , Cd , Hg. Questa è molto differente dalla disposizione del 1869 dove Be , Mg , Zn, Cd sono distanti da Ca , Sr , Ba. Il Torio è ora piazzato in modo corretto sotto il gruppo IV , con peso atomico 232 , confrontato con la posizione errata del Th con peso atomico 118 nella tabella del 1869 .
Gli elementi eka
Gli elementi eka mancanti di peso atomico 44, 68, e 72 sono indicati in modo chiaro , come è l’elemento mancante di peso atomico 100 ( per diventare tecnezio dopo il 1940 ) . Le proprietà previste degli elementi eka mancanti sono elencate nel suo libro di testo , l’idrogeno è ancora posto separatamente , ma questa volta in cima al gruppo I . Nel 1869 era ancora quasi libero di galleggiare . Nei quindici anni seguenti i tre eka elementi ( Ga , Ge , e Sc ) furono scoperti in natura e occuparono correttamente i loro posti nel sistema periodico . La loro identità fu confermata confrontando le loro proprietà al momento della scoperta con quelle previste da Mendeleev nel 1871 .
Ulteriori sviluppi della Tavola Periodica
Vennero poi isolati nel 1890 i gas nobili . Il sistema periodico dimostrava ora la sua potenza e flessibilità permettendo a questi nuovi misteriosi gas di essere incorporati nella tavola come elementi di un nuovo gruppo 0 , dopo gli alogeni nel gruppo VII e prima degli alcali nel gruppo I . La tavola presentata nella Figura 3 è tratta dalla edizione del libro di Mendeleev : Osnovy Khimii della edizione del 1905 , come mostrato nella edizione riveduta del libro del 1931 e titolata “System”. E’ chiaramente riconoscibile come la tabella in uso fino agli anni ’50 . I gas inerti sono ordinati a sinistra come gruppo 0 .
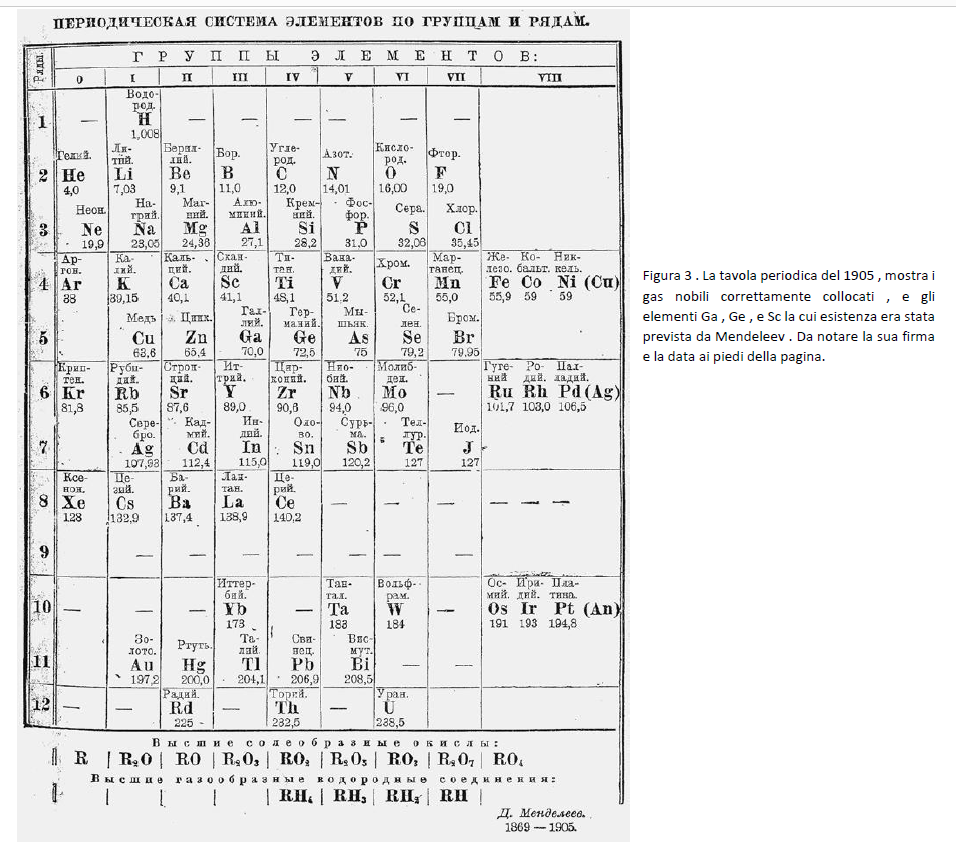
I metalli di transizione sono nel gruppo VIII sulla destra . I metalli Cu , Ag , Au , sono ancora un problema : dove piazzarli? Essi sono duplicati nei gruppi I e VIII , ma ora è la posizione nel gruppo VIII che è fra parentesi ( Nota l’errore di stampa : An per Au ) . Il radio, scoperto nel 1898 è assente . Mendeleev fu sempre dubbioso sulla esistenza di elementi naturali radioattivi . La tavola periodica del 1902 del suo amico Buhuslav Braumer è quasi identica nell’omettere il polonio . L’idrogeno è a sé , ma sopra il I gruppo . C’è un vuoto per un elemento nel VII gruppo , dopo Mo e sotto il Br , chiamato eka-manganese nel testo , numero atomico 99. Dei vuoti ben definiti nella riga 12 aspettano l’arrivo degli elementi radioattivi (rari) . C’è una serie di vuoti per gli elementi che seguono La, Ce . Gli elementi delle terre rare sono già riportati con pesi atomici da 141 ( Pr ) a 171 ( Tu ) , sebbene la loro identità non era certa . In una nota a piè di pagina Mendeleev commenta sulla difficoltà che trovò per collocare questi elementi , così che scelse semplicemente di ometterli . Egli dispone Yb sotto La, per il loro comune stato di ossidazione 3+ , e lascia un vuoto prima del Ta , per l’elemento che nel 1923 divenne l’hafnio, e una dopo W per il renio . Il simbolo per lo iodio è J.

Una Tavola Periodica alternativa
Tuttavia il sistema non è la sola organizzazione che Dmitrij Ivanovič Mendeleev presenta. Figura 4 riproduce una tabella originariamente stampata sulla pagina opposta alla tabella descritta sopra . In questa tavola Mendeleev ordina gli elementi secondo il peso atomico andando dall’alto al basso , con le colonne denominate “righe” e i “gruppi” orizzontali . Ma come nella tabella del 1869 , il gruppo II Be , Mg , Zn , Cd , è ben separato dai gruppo II Ca , Sr , Ba , Rd . I gas inerti sono duplicati in cima e in fondo come gruppo 0 , ma He , Ne appaiono essere in una posizione anomala adiacenti a Ni e Pd . Le colonne degli elementi da He a Ne e da Ne to Ar sono chiamati “ elementi tipici “. Questa disposizione di una serie continua in una colonna rende evidente che il set di Fe, Co fino a Ge e As è collegato strettamente al set Ru, Pd fino a Sn , e Sb , e al set, Os, Ir fino a Pb , e Bi. L’etichetta del blocco Fe, Co e Ni si trova erroneamente stampato come VII (dovrebbe essere VIII) . Quindi qui ci sono due tavole , molto diversi in apparenza, eppure entrambe dello scopritore della legge periodica e sistema periodico. Egli era soddisfatto di entrambe , altrimenti non le avrebbe pubblicato sulle pagine frontali nel suo libro .
L’eredità di Dmitrij Mendeleev ancora in evoluzione
La tavola finale di Mendeleev è un monumento per celebrare il centenario della sua nascita nel 1934 . Una rappresentazione artistica della sua ultima tavola periodica nella parete della Camera Principale dei Pesi e Misure in San Pietroburgo , Russia , e semplicemente chiamata “Sistema “ ( vedi Figura 5 ) . Questa versione è molto simile alla tavola del 1905 (Figura 3) , anche se sono stati aggiunti gli elementi radioattivi Rn , Ra , Ac , Pa , Po , così come i lantanoidi , incluso Jl , illinium , più tardi sarà dimostrato spurio . Il numero di elementi lantanoidi tra Ba e Hf è ora corretto , grazie al lavoro di Moseley . Non solo ciascun elemento ha il suo posto in questa tavola periodica , ora ciascuno è collocato nel sistema con il suo caratteristico numero atomico . C’è ancora un salto dopo Mo e sotto Br , anche se il Re è ora incluso nella tavola . I gas inerti , gruppo 0 , sono ben posizionati a sinistra del gruppo I . Ancora oggi c’è un gran dibattito circa la loro posizione nella tavola periodica . Da notare che i simboli iniziano con J e non con I : Jr, iridio ; In , indio . Le formule per gli ossidi e anidridi sono indicate in fondo alla tavola , così i numeri sono agli apici ( p.e. R2O5 e RH3del gruppo V ) , mentre in entrambe le tavole del 1871 e 1905 (Figura 2 e 3 ) , sono espresse nella moderna notazione come pedici , R2O5 e RH3 . In aggiunta , questo memoriale della tavola periodica era identificato con un codice di colori , con gli elementi scoperti dopo la morte di Mendeleev nel 1907 mostrati con il colore blu mentre i restanti erano in rosso .

Uno può chiedersi : c’è un forma corretta della tavola periodica ? Mendeleev ha in effetti già risposto a questa domanda per noi : vedi le Figure 3 e 4 . Nel libro del 1969 di Nekrasov abbiamo la sua versione modernizzata delle tavole del 1905 e del 1934 chiamate “ Sistema di Mendeleev “. Questa versione del 1969 (vedi Figura 6 ) è interessante perché i gas inerti diventano il gruppo VIII , e si frappongono tra gli alogeni , gruppo VII , e la “triade” , Fe , Co , Ni . I lantanidi e gli attinidi sono appartati e separati dal corpo principale della tavola periodica , come venne proposto per primo da Seaborg nella sua ipotesi sugli attinidi .

Naturalmente molte altre sistemazioni sono possibili ! Più che interessante è l’esistenza di due bozze grezze disegnate a mano da Mendeleev del suo primi “Sistema degli elementi “ del 1869 (vedi Figura 7 ) .
 In accordo con il suo sistema , gli elementi sono ordinati secondo il peso atomico , ma in una bozza il peso atomico cresce verso l’alto , mentre nell’altra sono ordinati con il peso atomico che aumenta verso il basso . Questa ultima versione diventa la sua prima tavola periodica , pubblicata nel 1869.
In accordo con il suo sistema , gli elementi sono ordinati secondo il peso atomico , ma in una bozza il peso atomico cresce verso l’alto , mentre nell’altra sono ordinati con il peso atomico che aumenta verso il basso . Questa ultima versione diventa la sua prima tavola periodica , pubblicata nel 1869.
Dmitrii Mendeleev nel 1869
Ci sembra opportuno ricordare Dmitrii Mendeleev come i suoi studenti lo vedevano , e come appariva quando egli stava creando il sistema periodico e queste prime tavole periodiche per essere usate nel suo libro di testo per i suoi studenti (Figura 8 ) . La URSS onorò lui e la sua prima tavola periodica pubblicando nel 1969 due francobolli che raffiguravano lui , la sua prima tavola periodica, e le sue previsioni .

Siti correlati
https://www.robertopoetichimica.it/nata-la-tavola-periodica-mendeleev/
https://www.robertopoetichimica.it/7758/


