Una riflessione didattica e storica su il primo libro di testo di Chimica al biennio dell’ITIS di Arezzo nel 1960
Per caso ho ritrovato il primo libro di testo di chimica adottato nel biennio dell’I.T.I.S. di Arezzo nel 1961, cioè quando venne fondata la scuola . Anche io mi iscrissi all’Istituto proprio nell’anno della sua apertura . Sfogliando un libro di testo di chimica di base si possono avere preziose informazioni sulla stato della didattica e sul nucleo di conoscenze disciplinari su cui si è basata l’impostazione del testo . Il testo è stato stampato nel 1961 , l’autore è il Prof. Marcello Seta che è stato insegnante all’I.T.I.S. di fermo . Il libro è integro nonostante sia trascorso più di mezzo secolo . In un corso di chimica di base tra i concetti fondanti vi è senza dubbio la classificazione periodica degli elementi e la natura del legame chimico . La classificazione periodica degli elementi è inquadrata in quella che può definirsi l’icona della chimica , cioè la Tavola Periodica .
Frontespizio del libro di testo

Quale Tavola Periodica è rappresentata nel testo ?
Nel testo è riprodotta la forma della seconda tavola periodica che fu proposta da Mendeleev nel 1871.
Figura 1 Tavola Periodica di Mendeleev 1871
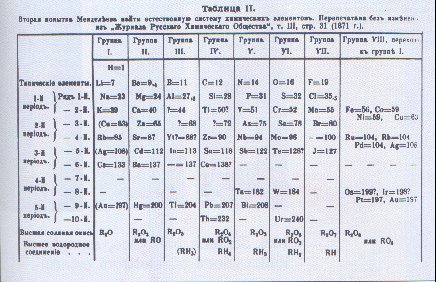
Figura 2 Univesità di San Pietroburgo : Statua di Mendeleev e Tavola Periodica 1871

Vi sono apportati dei cambiamenti , che sono piuttosto integrazioni , come l’apparizione alla estrema sinistra , dopo l’ottavo gruppo , del gruppo zero dei gas nobili , oppure l’ aggiunta di alcuni elementi transuranici e la serie dei lantanidi . Non abbiamo l’individuazione , come serie , degli elementi di transizione e soprattutto non sono collocati correttamente gli elementi actinio , torio , protattinio , uranio , nettunio , plutonio , americio , curio che rappresenterebbero la serie degli attinidi che , tuttavia , non è individuata nella tavola periodica ( Figura 3 ) .
Ma quali erano le conoscenze , ormai da anni acquisite , sulla struttura della tavola periodica ?
Le conoscenze sulla struttura elettronica dell’atomo avevano permesso di individuare le serie degli elementi di transizione , eliminando il gruppo ottavo della tavola di Mendeleev , mentre nei primi anni quaranta Seaborg aveva riconosciuto la serie degli attinidi come omologa a quella dei lantanidi , riorganizzando la tavola periodica e ricollocando correttamente gli elementi con numero atomico superiore all’actinio , tra cui l’uranio . La svolta di Seaborg era stata un fatto importante nella conoscenza della struttura atomica , frutto delle conoscenze maturate con la fisica nucleare . L’autore del libro di testo dunque è fermo a Mendeleev .
Figura 3 Libro di testo di chimica di base I.T.I.S. Arezzo 1960

La Grande Enciclopedia U.T.E.T.
A questo proposito anche nell’opera monumentale della U.T.E.T. “ IL GRANDE DIZIONARIO ENCICLOPEDICO “ pubblicato all’inizio del 1961 alla voce Tavola Periodica viene presentata la stessa versione del libro di testo di chimica (Figura 4)

Figura 4 Tavola Periodica dell’Enciclopedia U.T.E.T 1961
Due fonti molto diverse tra loro mostrano lo stessso ritardo
E’ sorprendente questo stato della conoscenza che emerge da queste due fonti . E’ difficile darsi una spiegazione . Non possiamo invocare l’ isolamento scientifico del paese Italia , prodottosi in alcuni settori del sapere durante il ventennio fascista perché sono passati quindici anni dalla fine della guerra e l’economia e l’industria stanno vivendo una grande stagione che è stata chiamata boom economico con la scienza e la tecnica che sono chiamate a dare un contributo importante . Cercheremo più avanti quando avremo concluso l’analisi del testo una spiegazione .
Come viene interpretato il legame chimico
Proseguendo nella nostra indagine incontriamo il capitolo dedicato al legame chimico . L’approccio al legame è essenzialmente quello che propose Lewis nel 1916 . L’atomo di Lewis fu sorprendentemente efficace a dare una spiegazione al legame chimico anche se le sue fondamenta fisiche erano errate . L’atomo di Lewis è statico , i suoi elettroni non sono in movimento . L’immagine dell’atomo cubico con i vertici occupati da elettroni che formano l’ottetto gli permette tuttavia di arrivare a concepire il legame come coppia di elettroni condivisi , nonché di spiegare i legami multipli.
Un modello fuori posto senza la sua storia
Nella storia della scienza abbiamo esempi di teorie , leggi scoperte malgrado premesse non correte. La concezione del calorico come fluido , cioè materia elementare , è un bell’esempio che non ha impedito a Carnot di gettare le basi della termodinamica . Ma se il modello di Lewis viene invocato senza comprendere il contesto storico in cui fu concepito viene trasformato da geniale intuizione a strumento anacronistico . L’autore del testo ripropone il modello statico di Lewis , come se , passati sessanta anni , non fosse da tempo ampiamente acquisita la natura dinamica degli elettroni dell’atomo .
Il legame chimico sospeso tra passato e presente
Egli si muove tra un modello di atomo statico ed elettroni che si muovono attorno al nucleo , come se la sua immagine dell’atomo fosse sospesa tra due opposte visioni . Cioè da una parte il modello di Lewis superato che non viene abbandonato e dall’altra una visione più moderna a cui sembra si sia impreparati . Insomma è come se si spiegassero i principi della termodinamica accettando che il calorico è un fluido materiale .
Alcune pagine del libro di testo di chimica
Le figure seguenti mostrano alcune pagine del primo libro di testo di chimica dove sono rappresentati la distribuzione elettronica di un gas nobile , quella del cloro e la molecola di ossigeno .
Gli elettroni in un gas nobile

Figura 5 Gli elettroni ai vertici di un cubo e la coppia interna rappresentano la geometria dell’ottetto di un gas nobi
L’ottetto incompleto del cloro

Figura 6 Gli elettroni nello strato più esterno del cloro sono rappresentati da un cubo con un vertice vacante
Il doppio legame nell’ossigeno

Figura 7 La struttura elettronica dell’atomo di ossigeno e il doppio legame nella molecola rappresentato dalla faccia in comune dei due cubi
L’ inerzia al cambiamento
La scelta di un libro di testo non riguarda solo l’autore , ma soprattutto chi lo usa . Penso quindi che le opinioni del nostro autore sugli argomenti che abbiamo analizzato non fossero cosi’ isolate . In quale scuola , in quale università si offriva questa cultura chimica ? Certamente in istituzioni dove la cultura veniva aggiornata molto lentamente , in istituzioni pigre che abbandonavano con grande inerzia vecchi punti di vista e con altrettanta resistenza si opponevano a nuovi punti di vista . Oggi , che sono passati cinquanta anni da ciò che abbiamo raccontato , abbiamo istituzioni diverse ? Nella scuola e nell’università la chimica è trasmessa con contenuti e metodi diversi , siamo di fronte , cioè , ad una nuova didattica ?Prendiamo per esempio due contenuti che possiamo trovare in un testo di chimica di base : Il legame dativo e la teoria quantistica dell’atomo.
Il legame dativo
Il legame dativo è una reminescenza dell’originale modello di legame di Lewis . Si doveva far rientrare nella regola dell’ottetto atomi che sembravano non obbedirvi . Insistere ancora è come non conoscere un modello di legame covalente o a coppia di elettroni modificato e arricchito dalle successive conoscenze sulla struttura elettronica e dalla introduzione della teoria della risonanza negli anni trenta .
La teoria quantistica dell’atomo .
A questo atteggiamento di resistenza sembrerebbe contrapporsi invece un salto deciso in avanti, quando agli studenti viene proposto il modello dell’atomo quantistico con i suoi orbitali e la loro misteriosa ibridazione . Chi è più propenso a questo approccio sembrano essere soprattutto gli insegnanti di scienze , a cui nelle scuole a indirizzo non tecnico è affidato l’insegnamento della chimica . Ma è proprio un salto in avanti ? Considerata la superficiale conoscenza che i chimici laureti hanno di questa teoria , per non parlare dei biologi , pare invece un pacchetto preconfezionato , offerto piuttosto acriticamente agli studenti , una specie di vulgata dell’atomo quantistico dove sono contenuti errori e approssimazioni . Ma questo è stato da molto tempo messo a fuoco dal Prof. Mirone dell’università di Modena che ha compiuto un grande lavoro di rinnovamento della didattica in chimica .
Cosa manca nella professionalità dell’insegnante di chimica , come delle altre discipline scientifiche che lo possa mettere nella condizione di saper valutare con senso critico ciò che trasferisce allo studente ?
La Tavola Periodica
Per rispondere riprendiamo la tavola periodica , il concetto di legame e la teoria quantistica dell’atomo . Supponiamo che nella preparazione dell’insegnante sia compresa la conoscenza storico -epistemologica dei momenti più significativi della propria disciplina . Il nostro insegnante di chimica sa come è nata la tavola periodica ; i suoi limiti iniziali , le ulteriori faticose acquisizioni ; lo sviluppo della conoscenza della struttura elettronica dell’atomo e l’adeguamento a questa della tavola periodica . Queste conoscenze e soprattutto l’acquisizione di una prospettiva storica non gli avrebbero consentito di adottare la prima tavola periodica di Mendeleev.
Il legame chimico
Se poi avesse letto l’articolo di Lewis sulla natura del legame chimico , conosciuto il contesto nel quale nacque , non avrebbe riproposto l’atomo cubico ai suoi studenti , né il legame dativo , ma avrebbe semmai fatto un percorso storico dove inserire anche l’atomo cubico e il legame dativo per far comprendere il cammino , tutt’altro che lineare , che ha portato a concepire la natura del legame chimico .
L’atomo quantistico
Infine se i concetti fondanti della meccanica quantistica fossero conosciuti nella loro dimensione storica , se vi fosse più consapevolezza della rivoluzione scientifica che essi segnarono e poi sopratutto del rapporto che c’è stato tra chimica e fisica quantistica , allora non accetterebbero mai di offrire ai propri studenti il pacchetto confezionato che gli offrono i libri di testo .
Allora quello che occorre , e da cui non si può prescindere , è la conoscenza storico epistemologica dei contenuti della propria disciplina .


