Una proposta didattica per il laboratorio di chimica.
Questa proposta didattica per il laboratorio di chimica è destinata ad un corso di chimica di base. L’oggetto della ricerca è il blu di Prussia la cui sintesi è presente in molte pagine web, in varie versioni . Quello che le accomuna è la semplicità di esecuzione. Alla sintesi del colorante viene aggiunta la ricerca del ferro nel sangue, una indagine legata alla costituzione del blu di Prussia e la sintesi di un colorante diverso da blu ottenuto impiegando sali di rame. Ma la novità della proposta didattica è la riproduzione di alcune esperienze compiute da Macquer nel 1752 che per la prima volta affrontano la composizione del blu di Prussia. Sono riportate alcune parti della memoria scritta da Macquer Esame chimico del blu di Prussia del 1752 relative alla descrizione di queste esperienze. L’attività di laboratorio in questo modo è vissuta come ricostruzione della storia della chimica che ebbe nell’attività di laboratorio il suo perno fondamentale.
Esperienza di laboratorio : la sintesi e l’analisi del Blu di Prussia.
E la proposta di alcune esperienze storiche sul colorante blu di Prussia


Procedimento:
- Preparare una soluzione satura di cloruro di ferro (III) mettendo 2.6 g di FeCl3 in un piccolo becher con 10 ml di acqua distillata. Usare un cilindro graduato per misurare il volume d’acqua da utilizzare. Mescolare per sciogliere.
- A parte, preparare una soluzione satura di ferrocianuro di potassio versando 2 g di K4[Fe(CN)6] in un altro becher con 10 mL di acqua distillata. Descrivere l’aspetto di queste soluzioni .
- Preparare il Blu di Prussia versando la soluzione di ferrocianuro di potassio nel becher con la soluzione di cloruro ferrico. Mescolare con una bacchetta di vetro. Descrivere cosa accade quando le soluzioni sono mescolate.
- Procurarsi della carta da filtro che si adatti all’imbuto Buchner (in modo che si appiattisca sul fondo).
- Quindi versare la miscela di reazione nell’imbuto. Raschiare tutto il prodotto blu dall’imbuto: utilizzare un po’ di acqua distillata per sciacquare il becher.
- Mettere la carta da filtro su alcuni tovaglioli di carta all’interno del cassetto del laboratorio e lasciare asciugare il Blu di Prussia ottenuto. Descrivere l’aspetto del pigmento, sia quando è bagnato che dopo che si è asciugato.
Riflessioni:
- Scrivere la reazione che sta procedendo in questa sintesi.
- Trovare molti altri scopi per questa sostanza, oltre quello di colorante nelle vernici
Un colorante alternativo con sali di rame
Il ferrocianuro potassio reagisce con molti sali di metalli dando colori caratteristici. Al posto del tricloruro di ferro si aggiunge al ferrocianuro una soluzione satura di un sale di rame, come dicloruro di rame diidrato CuCl2·2H2O, ottenuta sciogliendo 3,1 g in 10 mL in acqua distillata. Si ottiene un precipitato rosso.
I globuli rossi del sangue contengono ferro
Una piccola quantità di fegato di suino o bovino è spremuta e lavata con pochi mL di acqua distillata. L’acqua di lavaggio è fatta evaporare a piccolo volume e poi calcinata in un crogiolo. Il residuo è sciolto in acido cloridrico . Alla soluzione sono aggiunte alcune gocce di soluzione di ferrocianuro. La presenza dello ione ferrico è rivelata dalla formazione del blu di Prussia.
Riproduciamo alcune esperienze storiche sul blu di Prussia di Pierre-Joseph Macquer
Questa esperienza di laboratorio che riguarda la sintesi del blu di Prussia, primo colorante sintetico, è di grande semplicità. Si tratta di miscelare le soluzioni di due reagenti e osservare il formarsi di un bel precipitato blu. In realtà in origine, quando fu scoperta la sintesi del blu di Prussia (1706), il procedimento era molto complesso e consisteva in diversi passaggi : si partiva da sangue di bue che veniva coagulato, poi essiccato e mescolato con potassa. La massa veniva fatta calcinare in un fornello, raffreddata e poi ripresa con acqua e filtrata più volte. La soluzione filtrata era chiamata la liscivia si sangue ed era la parte fondamentale. Per ottenere il blu di Prussia occorreva mescolare questa liscivia con un sale di ferro. Seguivano una serie di filtraggi e lavaggi , prima di arrivare ad ottenere un prodotto commerciabile. Lo studio della composizione e struttura del colorante ha coinvolto diverse generazioni di chimici, a partire dal 1724, anno in cui venne rivelato il procedimento per la sua preparazione. Tuttavia il primo lavoro rilevante che getta luce sulla composizione e struttura del blu di Prussia di deve al chimico Pierre-Joseph Macquer ( 1718-1784) di una generazione più anziano di Lavoisier.

Pierre-Joseph Macquer ( 1718-1784) Medico e chimico francese
Egli espose i risultati del suo meticoloso lavoro sperimentale nella rivista Histoire de l’Académie royale des sciences avec les mémoires de mathématique et de physique del 1752 in un articolo dal titolo Esame chimico del blu di Prussia. La memoria di Macquer è un documento di rilevanza epistemologica. Si tratta di una serie di esperienze che hanno come oggetto l’ analisi in parallelo alla sintesi del blu di Prussia, che egli conduce sul colorante, attraverso le quali, mediante l’applicazione articolata di un ragionamento ipotetico deduttivo, ottiene importanti risultati. Questo impiego maturo e consapevole del metodo sperimentale è tanto più sorprendente se si pensa allo stato della scienza chimica nel suo tempo. Siamo in un periodo che ancora vede lontana dall’orizzonte la rivoluzione di Lavoisier, un periodo nel quale verità precostituite e prescientifiche formano l’impianto a cui piuttosto i risultati sperimentali devono conformarsi. Nel suo incipit la memoria di Macquer ci fa subito comprendere il diverso approccio di quest’ultimo allo studio del blu di Prussia rispetto ai suoi colleghi chimici:
Tutti i Chimici che hanno lavorato fino ad ora sul blu di Prussia hanno cercato di conoscerlo e perfezionarlo solo riproducendolo; e i tentativi che hanno fatto hanno avuto per oggetto, talvolta gli alcali saponosi [ soda e potassa] che hanno cercato di preparare in diversi modi, oppure variando la qualità e la quantità delle sostanze infiammabili [ materiale organico come sangue di bue ecc.] con cui erano calcinati gli alcali, e il grado di calcinazione; a volte si cercava di variare le dosi degli ingredienti che si impiegano nella preparazione di questo azzurro, di sottrarne un po’, di aggiungerne di nuovi, e di combinarli diversamente: è anche il metodo che io seguii tanto a lungo, che il mio unico scopo, era perfezionare il blu di Prussia come colorante; ma quando mi decisi di esaminarlo chimicamente per scoprire esattamente quale fosse la sua natura, seguii una strada molto diversa, vale a dire, esaminare il blu di Prussia già pronto, sottoporlo a diversi test chimici e cercare di scomporlo, che nessuno ha fatto finora in modo decente; quindi l’oggetto di questa memoria è, in senso stretto, l’analisi del blu di Prussia.
Il lavoro di Macquer si colloca in una ottica nuova rispetto alla chimica del suo tempo. Egli procede sulla strada dell’analisi oltre alla sintesi del blu di Prussia . Il processo di analisi non era ovvio, e dimostra come stia iniziando a pensare in termini di corpi più semplici rispetto a corpi più complessi . È un risultato rilevante per uno che si colloca in una cornice culturale pre-Lavoisier, che vede ancora la chimica legata alla teoria del flogisto e alla teoria dei quattro principi. Il ferro, per esempio, che entra nella preparazione del blu di Prussia non è un elemento nel senso poi definito da Lavoisier, il ferro e il suo ossido non sono corpi chiaramente distinti. Le esperienze che conduce Macquer sono numerose, si possono scegliere alcune più significative e riproporle in una esperienza di laboratorio che arricchisca quella che è la semplice sintesi del blu di Prussia che è stata prima esposta. I risultati di Macquer furono così rilevanti che ad essi si ispirarono Priestley, Scheele, Berthollet, Gay-Lussac e Berzelius.
Seguiamo Macquer nel suo tentativo sull’ analisi e la sintesi del blu di Prussia. Abbiamo prodotto il colorante con la sintesi precedentemente descritta, lo utilizzeremo riproducendo le analisi di Macquer . La lettura dei passi in cui Macquer descrive e articola le sue esperienze ha un aspetto educativo importante. Si ricrea un contesto storico che ha valore epistemologico , ma che anche altamente suggestivo. Riproponiamo solo alcune parti del lavoro di Macquer, le esperienze più fattibili e più comprensibili da riproporre in un laboratorio scolastico. Prima ha calcinato il blu di Prussia ottenendo un residuo che ha un colore giallo e che è attratto dalla calamita. Si tratta di ossido ferrico:
Ho iniziato presentando al blu di Prussia ben lavato e asciugato una calamita che non ne attirava nessuna parte. Sapevamo già , e M. l’Abbé Ménon lo menziona nelle sue Memorie, che il blu di Prussia non è attratto dal magnete; ma ciò che non sapevamo, e ciò che lo stesso M. l’Abbé Ménon non disse, sebbene fosse qualcosa che poteva pensare plausibile, è che questo stesso blu, essendo calcinato, diventa del tutto attrattivo dalla calamita. Ecco come ho fatto questo esperimento: ho messo il blu di Prussia ben lavato e asciugato in un crogiolo posto tra i carboni ardenti, si sono formati dei vapori che avevano un odore molto marcato di alcali volatili [ ammoniaca ] (fenomeno che M. Geoffroy il giovane osservò anche nella distillazione di blu di Prussia) e man mano che si esalano questi vapori, il colore azzurro scompare per lasciare il posto ad un colore giallo di ruggine o di zafferano di marzo, che ciò che è rimasto nel crogiolo ha sempre conservato: questa polvere gialla, presentata alla calamita, è attaccata ad esso interamente.
L’indagine continua , sottoponendo il blu di Prussia all’azione degli acidi :
Dopo queste prime prove ne ho fatte alcune di altro tipo, cercando di scomporre il blu Prussia mediante i principali solventi chimici. Benché avessi ragione di presumere che gli acidi non agissero su questo azzurro, poiché è lavato con una certa forza con acido per dargli bellezza e vivacità, tuttavia credevo che sarebbe stato opportuno esaminare se questo tipo di solvente non alterasse in alcun modo, principalmente quando è stato aiutato dal calore. Così ho versato separatamente i tre acidi minerali sul blu di Prussia, e dopo aver fatto bollire questi acidi con questo blu, non ho notato alcuna alterazione apprezzabile in questo colore, se non che ne avevano aumentato un po’ l’intensità: questi stessi acidi, poi sottoposti ad opportuni esperimenti, sembrava non aver sciolto nulla del blu di Prussia tranne un po’ di terra alluminosa.
Poi lo sottopone all’azione degli alcali, come il carbonato di potassio, nitre fixé par le tartre ( che era ottenuto da tartaro grezzo, cioè potassio idrogeno tartrato, e nitrato di potassio essiccato, mescolati e fatti esplodere con carbone per dare un alcali che era sostanzialmente carbonato di potassio) :
Credo che si possa concludere da questi esperimenti, che gli acidi non hanno alcuna azione sul blu di Prussia, anche quando sono aiutati da un calore piuttosto considerevole. Dopo aver così tentato invano di scomporre il blu di Prussia con acidi, ho fatto ricorso agli alcali. Ho messo mezza oncia di questo azzurro in un fiasco, e ho versato sopra dieci once di liquore di nitro fissato dal tartaro [carbonato di potassio]. Appena queste due sostanze furono mescolate insieme vidi con stupore, che senza l’aiuto del calore il colore azzurro era del tutto scomparso, la polvere dal fondo del matraccio aveva solo un colore grigio piuttosto spento: avendo posto questo recipiente su un bagno di sabbia per scaldare il liquore fino a farlo bollire leggermente, anche questo colore grigio è scomparso del tutto; e tutto ciò che era contenuto nella storta, sia la polvere che il liquore, aveva solo un colore giallo leggermente rossiccio.
La polvere è in prevalenza costituita da ossidi-idrossidi di ferro III, di colore giallo rossiccio e la soluzione o liquore che appare gialla è ferrocianuro di potassio, secondo la reazione

In soluzione alcalina il blu di Prussia libera la componente ferrica sotto forma di precipitato di idrossido (si tratta più precisamente di ossidi idrossidi FeO(OH) di ferro III) , mentre la componente ferrocianuro gialla rimane disciolta in soluzione. Che nessuno prima avesse sottoposto il Blu di Prussia agli acidi e alle basi conferma la novità dell’approccio di Macquer orientato all’analisi . L’effetto esercitato dagli alcali pone nuove domande. Si accerta che l’azione degli alcali sia completa e poi esegue prove distinte sulla polvere residua :
Per farmi una opinione in merito, decisi di esaminare sia la polvere gialla, che era solo blu di Prussia scolorito, sia il liquore alcalino che aveva portato via il suo colore; e per essere sicuro che l’alcali avesse fatto sul blu di Prussia tutto l’effetto che era in grado di produrre, ho versato nuovo alcali in questo blu già scolorito e ingiallito, l’ho fatto bollire in questo alcali, che era nitro fisso [carbonato di potassio], lo stesso del primo esperimento; dopo di che ho filtrato il liquore, e ho lavato con molta cura la polvere gialla rimasta sul filtro, finché l’acqua in cui l’avevo lavato era perfettamente insapore: ho poi versato acqua forte [ acido nitrico] su parte di questa polvere lavata; vi fu una grande effervescenza, la polvere si sciolse, e il tutto rimase giallo senza che apparisse alcuna traccia di azzurro. Ho messo l’altra parte della polvere gialla in un crogiolo, l’ho carbonizzata fino a farla diventare un po’ rossa, dopodiché l’ho presentata ad una sbarra di ferro magnetica che l’ha attratta interamente, come ferro puro.
La solubilizzazione completa del campione di polvere si spiega con la sua composizione di ossidi-idrossidi di ferro III e degli eventuali carbonati. Una seconda porzione di polvere è invece calcinata e trasformata in ossido ferrico rosso ruggine:
Essendo questi esperimenti una prova completa che ciò che rimane del blu di Prussia dopo che è stato scolorito dall’alcali non è altro che ferro, ho concluso che l’alcali decompone questo blu e dissolve tutto ciò che non è ferro, e quindi ho rivolto tutta la mia attenzione su questo alcali che aveva così scolorito il blu, essendo convinto che avrei trovato lì tutto ciò che mancava al ferro di essere blu di Prussia.
Macquer rivolge la sua attenzione sulla soluzione che ha scolorito il blu di Prussia. Aggiunge Blu di Prussia fino a saturare la soluzione. Se la soluzione alcalina si è saturata, cioè se tutta la sua alcalinità è stata impegnata nella reazione di Fig.1, Macquer lo dimostra provando la neutralità della soluzione:
Ho filtrato il liquore, poi aveva un bel colore giallo limone [ il colore del ferrocianuro]; l’ho assaggiato, non mi è sembrato avere alcun sapore alcalino, il che mi ha portato a giudicare che non solo l’alcali era caricato il più possibile con la materia colorante del blu di Prussia, ma che questa materia aveva provocato la perdita delle sue proprietà alcaline, e l’aveva, per così dire, neutralizzata: l’ho mescolata, per assicurarmi, con sciroppo di violetta [ un indicatore di acidità], il cui colore non cambiava; poi ci ho versato dell’acqua forte, e questo acido non produceva la minima effervescenza, la quale non mi lasciava alcun dubbio che il mio sale, prendendosi carico della materia colorante del blu di Prussia, aveva effettivamente perso tutte le sue proprietà alcaline, come avevo prima sospettato.
La soluzione di un bel colore giallo limone è una soluzione di ferrocianuro [FeII(CN)6─ 4]. Macquer compie altre esperienze dalle quali trae l’indicazione di aggiungere un sale di ferro alla soluzione ottenuta precedentemente. Egli utilizza solfato ferroso che da per prima un precipitato azzurrognolo di ferrocianuro ferroso che si trasforma per ossidazione a ferrocianuro ferrico. Il ferrocianuro di potassio, K4[Fe(CN)6], contenuto nella liscivia alcalina, produce in soluzioni di sali ferrosi, con completa esclusione dell’aria, un precipitato bianco di ferrocianuro ferroso di potassio o di ferrocianuro ferroso, a seconda che una o due molecole di sale ferroso reagiscano con una molecola di ferrocianuro di potassio:
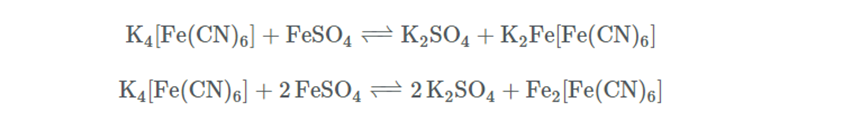
Sebbene entrambi i sali di cui sopra siano bianchi, si ottiene quasi sempre un colore azzurro, perché il precipitato viene immediatamente ossidato, come visto precedentemente in qualche modo dall’aria, formando il sale ferrico dell’acido idroferrocianico (blu di Prussia):

Ottiene un precipitato che è blu di Prussia aggiungendo alla soluzione alcalina satura della materia colorante un sale di ferro come il solfato ferroso. Ha compiuto prima una analisi, ora effettua la sintesi del blu di Prussia . L’ analisi e la sintesi del blu di Prussia sono usate come processi di verifica dell’identità del composto:
..così, per separare da questo alcali tutto ciò che aveva disciolto di questa parte colorante, si trattava forse solo di mescolarlo con una quantità opportuna di ferro sufficientemente diviso; che, infine, se così fosse, il mio alcali, scolorendo il blu di Prussia, era diventato con una semplice digestione un’ottima liscivia atta a riprodurre questo blu, e di conseguenza, senza alcuna calcinazione, assolutamente simile a quello che viene preparato per questo scopo, calcinandolo con sostanze infiammabili [cioè con il metodo tradizionale]. La miscela del mio liquore alcalino con una soluzione di vetriolo verde ha presto chiarito i miei dubbi; questa miscela ha prodotto un precipitato verde di montagna, accompagnato da una schiuma blu, proprio come accade quando si prepara il blu di Prussia con la liscivia ordinaria : finalmente un po’ di acido versato su questo precipitato, lo mutò interamente in un blu estremamente brillante.
Macquer indagherà sulla materia colorante contenuta nella soluzione alcalina sottoponendola a calcinazione e constatando che :
C’è anche ragione di credere che quando questa materia sperimenta così l’azione del fuoco in entrambi i casi [ la materia colorante, o ferrocianuro, e il blu di Prussia ], non si disperde interamente in vapori, ma si decompone; una parte si trasforma in alcali volatili [ammoniaca] ed esala in vapori, il resto diventa interamente carbonioso e rimane fortemente attaccato alla sostanza con cui è stato inizialmente unito: un occhio nero, che una calcinazione sufficientemente forte non potrebbe rimuovere dagli alcali, e la proprietà di essere alterabili dalla calamita, acquisita dal blu di Prussia scolorito dalla calcinazione, sono prove di quanto sostengo.
La calcinazione del residuo, al calor rosso, che ha ottenuto dopo aver evaporato a secco la soluzione alcalina contenente ferricianuro di potassio, ha prodotto alcali volatili, cioè ammoniaca, e un residuo nero carbonioso che potrebbe contenere grafite, ferro e cementite oltre a ossido di potassio. Macquer che è riuscito a isolare il ferrocianuro e mettere in evidenza con la calcinazione un residuo che è attratto dalla calamita come accadeva per la calcinazione del blu di Prussia non comprende che nel blu di Prussia sono contenute due quote di ferro, la prima che si separa per alcalinizzazione dello stesso Blu come lui ha accertato e l’altra per calcinazione della materia colorante che resta in soluzione dopo la decolorazione del blu di Prussia, altro risultato da lui raggiunto. Ma va sottolineato ancora che una deduzione del genere non era raggiungibile neppure ad un acuto osservatore come Macquer.
Le esperienze di analisi e sintesi del blu di Prussia compiute da Macquer
Esperienza n.1
Dopo aver ottenuto Blu di Prussia dalla sintesi precedente , prendiamo una quantità pari ad una punta di spatola e la aggiungiamo, mescolandola, in un becher contenente pochi mL di soluzione di acido cloridrico diluito. Il colorante resta invariato. Si possono usare anche acido solforico e nitrico diluiti, ottenendo un risultato analogo.
Esperienza n.2
Prendiamo una punta di spatola di Blu di Prussia e la aggiungiamo, mescolandola, in un becher contenente circa 5 mL di soluzione satura di carbonato di potassio. Il blu di Prussia si decolora. Si aggiungono altre aliquote di blu di Prussia fino alla saturazione della soluzione alcalina. La soluzione dovrebbe risultare neutra o leggermente basica alla carina indicatrice. La prova mostra, a differenza della esperienza n.1, uno dei punti deboli del colorante blu di Prussia, cioè la sua instabilità in condizioni basiche.
Esperienza n.3
Dall’esperienza n.2 si ottiene una soluzione che ha un colore giallognolo (ferrocianuro) e un residuo giallo arancio ( ossido idrossido ferrico). Si separa il residuo dalla soluzione. Metà del residuo viene disciolto in una soluzione acida per acido cloridrico e nulla soluzione può essere ricercato il ferro. L’altra metà è calcinata fino ad ottenere ossido di ferrico color ruggine, sul quale può essere fatta la prova con un magnete.
Esperienza n.4
Ad un terzo della soluzione di ferrocianuro color giallo vengono aggiunte piccole aliquote di cloruro ferrico. Si ottiene il precipitato blu di Prussia ( agire in ambiente acido)
Esperienza n.5
Un altro terzo della soluzione viene fatta evaporare lentamente fino a ridurla a piccolo volume. Viene lasciata essiccare, fino all’ottenimento di cristalli gialli di ferrocianuro di potassio.
Esperienza n.6
L’ultimo terzo della soluzione viene calcinato fini ad ottenere un residuo che presenta proprietà magnetiche del ferro.
Le esperienze sono una riproduzione di una parte del lavoro compiuto da Macquer sul blu di Prussia , eccetto la n.5, che sarà compiuta da altri in seguito. Macquer in definitiva separa il ferro III dal blu di Prussia (ferrocianuro ferrico), ottenendo ferrocianuro in soluzione e successivamente il ferro II dal ferrocianuro. Sono due stati diversi di ossidazione del ferro che vanno a formare il blu di Prussia. Il ferro II è coordinato con lo ione cianuro a formare il complesso Fe (CN)6 -4 . Il ferro III è il controione . Macquer che si muove nell’ambito delle conoscenze della chimica di metà settecento non possiede il concetto di composto, né tantomeno sa distinguere un composto con due distinte forme di ferro.


